Развитие технологий не стоит на своем месте. Особенно радует то, что технологии не только для потребления, но также и для борьбы с тяжелыми, и даже неизлечимыми болезнями.
Еще в 2016 году были получены результаты реальных успехов в борьбе с раком. Сотрудникам Центра исследований рака имени Фреда Хатчинсона в Сиэтле удалось вылечить более половины пациентов со злокачественными образованиями, а точнее с лейкозом. Это было экспериментальным лечением, и оно себя оправдало, показав неплохие результаты, а у некоторых пациентов лечение привело к рассасыванию опухоли. 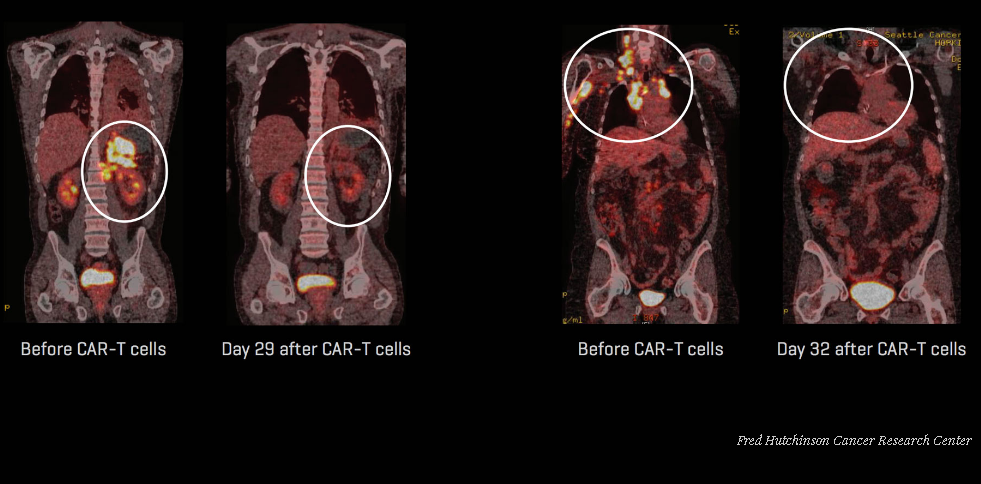
Таких результатов достигли, используя технологию химерных антигенных рецепторов. Химерные антигенные рецепторы – CAR (сhimeric antigen receptor) впервые были предложены израильским химиком, иммунологом Зелигом Эшхару из Института наук имени Вейцмана еще в 1989 году. Тогда же были получены первые трансгенные Т-лимфоциты с этими рецепторами.
Суть данного метода в том, что химерный рецептор позволяет лимфоциту точно распознавать опухолевые клетки, которые надо уничтожить. Более того, не только распознать, но и начать активировать злокачественную клетку. Именно в CAR есть фрагмент, который «будит» Т-лимфоцит при контакте с заданным типом клеток.
Для понимания работы важно знать, что на поверхности всех клеток есть рецепторные комплексы, в состав которых входит Т-клеточный рецептор, которые отвечает за распознавание и сигнальный модуль CD3, который активирует лимфоцит для борьбы с чужеродными клетками, точнее с их антигенами. Активированный лимфоцит убивает зараженную клетку или выделяет специфические белки, которые привлекают иммунные клетки на помощь.
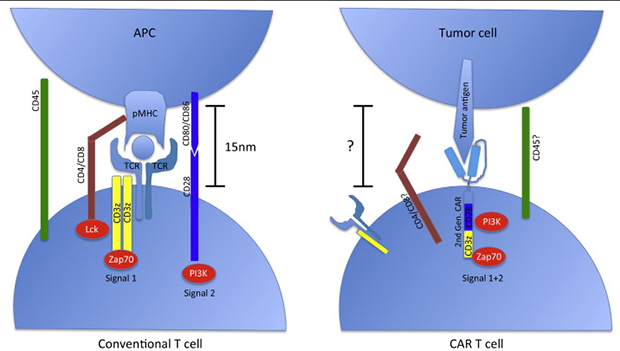
То есть по сути, химерный рецептор это когда вместо простого рецепторного комплекса синтезирует CAR. Тогда это целая «армия клеток», которые собраны в единую молекулу и умеют распознавать врага. Клетки по одному ничего такого не умеют, а вместе это хорошее оружие против рака.
Для создания такого комплекса используют шарнир иммуноглобулина G1, который позволяет отклоняться в разные стороны для лучшего связывания с антигеном.
Все составляющие рецептора собраны в одну аминокислотную последовательность и кодируются одним геном, что позволяет целенаправленно активировать лимфоциты.
Это все описано CAR первого поколения. На сейчас известно CAR-ы второго и третьего поколения, где вводятся разные клетки-активаторы. Такие рецепторы более эффективные, усиливают действие и имеют более выраженный терапевтический эффект.
В случае с ранее упоминаемыми сотрудниками Центра Фреда Хатчинсона, в CAR был введен дополнительно ген рецептора эпидермального фактора роста человека. Это было сделано для облегчения введения препарата, а также для того, чтобы его можно было быстро извлечь в случае побочных эффектов такой терапии.
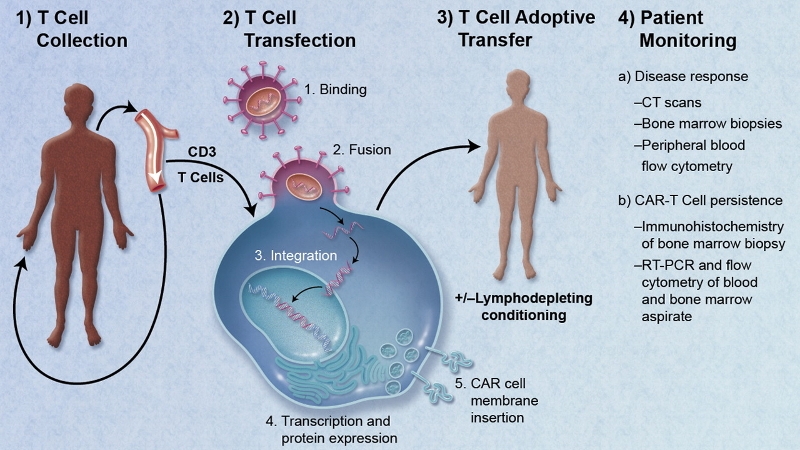
Для получения клеток у пациентов берут образец крови, потом с помощью приборов отбирают нужные Т-лимфоциты и культивируют их на питательной среде, потом добавляют в нее обезвреженный вирус, содержащий ген CAR, который специфичен для клеток опухоли пациента. Полученные лимфоциты активируют специфическими белками (цитокинами) и вводят пациенту.
Это аутологичные клетки. Ведутся работы по получению аллогенных клеток, то есть тех, которые отобраны в здорового пациента и у них выключают собственный Т-клеточный рецептор.
Для транспортировки рецепторов используются очищенные лентивирусы. Они большие, способны встраивать трансгены в ДНК, хорошо работают ex vivo. Их легко создавать, очищать и производить. К таким вирусам относится и ВИЧ, но когда вирус вводится пациенту, то он уже обработан и не может вызвать заболевание.
Метод имеет недостатки:
-синдром выброса цитокинов или «цитокиновый шторм»- это одновременное выделение большого количества клеток иммунной системы в ответ на введение трансгенных клеток. Симптомы – резкое повышение температуры, озноб, диарея, рвота. Такое состояние излечимо в условиях клиники.
— нетаргетный эффект – это атака CAR-T-лимфоцитов на здоровые клетки. Это происходят тогда, когда антигенны опухолей используют разные ткани для передвижения. Для его избежания используют мультиспецифичные CAR-клетки, которые имеют два и более химерных рецепторов. Или создают CAR, которые при активации вызывают экспрессию трансгенных цитокинов, а они привлекают в опухолевую ткань иммунные клетки организма.
Существуют и технологии «аварийного выключения» химерных рецепторов в случае развития серьезных побочных эффектов.
— дороговизна и несовершенство метода. Технология быстро развивается, но все равно идут и эксперименты, и клинические исследования. Лечение одного пациента аутологичными клетками обходится где-то в 100 тыс. долларов США. С развитием технологии, конечно же, стоимость такого лечения уменьшится.
После излечения трансгенные лимфоциты остаются в организме. Часть из них гибнет, а часть защищают человека от той формой рака, от которой он излечился.
30 августа 2017 года Управление по контролю за продуктами питания и лекарственными средствами США(FDA) выпустили официальный релиз, в котором одобрили терапию генномодифицированными лимфоцитами (CAR-T) для лечения лейкемии. Это первый случай выхода на рынок подобного препарата.
Владельцами этой технологии выступила фармацевтическая компания Novartis. Лечение препаратом Kymriah рекомендовано для людей до 25 лет с острой лимфобластной лейкемией, которым не помогли остальные методы лечения, или после рецидива болезни. В результате испытаний 83 процента пациентов выздоровели в течении трех месяцев (52 из 63)/
Стоимость лечения в даном случае составляет 475 тысяч долларов США. В ближайшее время Novartis планирует к открытию 32 центра, где будут лечить с помощью CAR-T.
В октябре 2017 года FDA одобрило новый препарат Yescarta(аксикабтаген цилолейкел (KTE-C19, Axi-cel). Это разработка компании Kite Pharma. Препарат Yescarta предназначен для взрослых пациентов.
Клинические данные показывают, что в случае с препаратом Yescarta 72% показали положительную реакцию, а 51% удалось добиться полной ремиссии.
В декабре 2017 года, использование CAR-T показало эффективность и безопасность в борьбе с миеломой.
В случае миеломы главный маркер BCMA (B-Cell Maturation Antigen), против которого и направлены геномодифицированные лимфоциты. И для борьбы испытывают лимфоциты, которые имеют рецепторы против того самого BCMA.
Исследования ведутся исследователями из Университета Пенсильвании в сотрудничестве с фармацевтической компанией Novartis.
Апробация препарата показала, что при терапии снизилась концентрация злокачественных клеток. Также модифицированные Т-лимфоциты ввели пациентам параллельно с химиотерапией. При маленькой дозе препарата показатели миеломного маркера снизились, при большой дозе – улучшение наступило у 8 из 10 человек.
На конференции Американского гематологического общества Адам Коэн обратил внимание на то, что полученные данные говорят о перспективности данного направления и, что клинические испытания будут продолжаться.
Как видим, технологии не стоят на месте, кто-то ищет возможность вывести людей на Марс, а кто-то пытается спасти их на Земле.


Комментарии:
No Comments